Dosage sur sérum, plasma, ou culture cellulaire de molécules à faibles concentrations
Cyril Martin
LIBM EA 7424, Université Lyon 1
L’ELISA, (= Enzyme Linked Immuno Sorbent Assay) est une technique de dosage immunologique qui permet de quantifier les concentrations de diverses molécules présentes notamment dans les liquides biologiques. Elle est très utilisée notamment pour le dosage des cytokines, des facteurs de croissances, et de certaines hormones. Cette technique dispose d’une grande fiabilité et d’une grande reproductibilité car elle repose sur le principe de fixation spécifique d’un antigène à son anticorps.
Outre la connaissance des bonnes pratiques de laboratoire, cette technique ne nécessite pas de pré-requis particulier. Il est cependant important de bien se documenter au préalable sur les concentrations approximatives de la molécule d’intérêt attendues dans le liquide étudié afin de bien déterminer les dilutions adéquates avant la mise en œuvre du dosage.
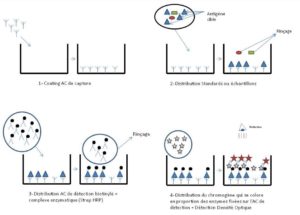
Le principe de l’ELISA consiste à piéger, entre un « anticorps de capture » et un « anticorps de détection », les antigènes d’intérêt.
Ces deux anticorps sont généralement spécifiques de l’antigène d’intérêt (parfois l’anticorps secondaire réagit aux complexes antigène-anticorps). L’anticorps de détection est dans la plupart des cas biotinylé. Cette caractéristique lui permet de se fixer à un complexe enzymatique (une peroxydase, telle la Streptavidine-HRP). La détermination des concentrations en antigène se fait en ajoutant un chromogène ou un fluorogène à ces complexes, par la lecture (généralement sur microplaques) de densités optiques ou de fluorescence émise.
Les ELISA se présentent soit sous forme de kits prêts à l’emploi (plaques pré-coatées livrées avec tous les réactifs nécessaires), soit sous forme de kits à préparer (sont livrées les paires d’anticorps de capture et de détection, l’enzyme et parfois le chromogène), soit peuvent se monter en autonomie. De nombreux fournisseurs sont présents sur le marché.
Cette technique permet une mesure fiable et reproductible de molécules présentes à très faibles concentrations (du nanogramme au picogramme/ml) dans le plasma, le sérum, ou les surnageants de culture cellulaire.
MATERIEL REQUIS
Nous présenterons ici la solution intermédiaire, à savoir la mise en place d’un ELISA à l’aide d’une paire d’anticorps fournie par un fournisseur.
- Lot de pipettes simples +, 1 pipette multicanaux (+ les pointes correspondantes)
- Microplaque 96 puits (attention à bien choisir une plaque facilitant l’accrochage des anticorps de capture : type « Nunc Maxisorp Immuno »
- Paire d’anticorps (de capture et de détection)
- Streptavidin-HRP
- Chromogène TMB (tétraméthylbenzidine)
- Standard de l’antigène d’intérêt
- Tampon de coating (PBS pH 7,2-7,4)
- Tampon de Rinçage (PBS 0.05 Tween20)
- Tampon de Saturation ( PBS 5%BSA)
- Tampon de dilution (PBS 1%BSA)
- Tampon de dilution HRP-Strep (PBS 0.1tween 20 + 1%BSA)
- Acide sulfurique 1M
- Lecteur de microplaque
ETAPES
Les volumes de réactifs utilisés et distribués peuvent varier en fonction de l’expérimentation.
1- Coating :
J-2
0- Préparer les tampons de coating, de rinçage et de saturation.
1- Diluer l’anticorps de capture selon les recommandations du manufactureur dans le tampon de coating
2- Etape clé, Extrême Précision requise : Distribuer 100µl de ce mélange dans chaque puits
3- Couvrir la plaque et laisser incuber la nuit à 4°C
J-1
4- Rincer chaque puit 2 fois avec 300µl de tampon de rinçage
5- Bloquer les puits avec 250µl de tampon de saturation pendant 2 heures à température ambiante
6- Vider la plaque (taper sur du papier absorbant) et laisser sécher 24h sur la paillasse
LA PLAQUE PEUT ÊTRE CONSERVEE A 4°C 2 SEMAINES AU PLUS
Jour J
2- Préparation de la gamme (triplicate):
A- Reconstituer le standard (à concentration Initiale [C] connue)
B- Constituer une gamme par dilution de moitié de la concentration précédente. Un minimum de 6 points de gamme + un blanc sont recommandés (0, [C], [C]/2, [C]/4, [C]/8, [C]/16, [C]/32)
[C] -> si possible préparer 800µl de standard
[C]/2 -> 400µL Tampon de dilution + 400µL [C]
[C]/4 -> 400µL Tampon de dilution + 400µL [C]/2
[C]/8 -> 400µL Tampon de dilution + 400µL [C]/4
[C]/16 -> 400µL Tampon de dilution + 400µL [C]/8
[C]/32 -> 400µL Tampon de dilution + 400µL [C]/16
3- Méthode :
1- Diluer les échantillons (plasma, serum ou surnageant de culture cellulaire) dans du tampon de dilution (cf bibliographie selon l’antigène d’intérêt et le liquide étudié)
2- Distribuer 100µl d’échantillon ou de gamme dans chaque puit (penser à ajouter un blanc) en triplicate
3- Diluer l’anticorps de détection (biotinylé) dans son tampon puis distribuer 50µl de ce mélange dans chaque puit
4- Laisser incuber 1 heure à température ambiante ·
5- Rincer 3 fois avec 300µl de Tampon de rincage
6- Diluer la streptavidin-HRP dans son tampon puis dispenser 100µL dans chaque puit
7- Laisser incuber 20 Min à température ambiante º
8- Rincer 3 fois avec 300µl de Tampon de rincage
9- Distribuer 100µl de TMB (prêt à l’emploi), couvrir de papier aluminium et laisser incuber 10-15 minutes (surveiller la couleur(Bleu))
10- Stopper la réaction avec 100µl d’acide sulfurique à 1M è Jaune
11- Lecture à 450nm
INTERPRETATION DES RESULTATS/ANALYSE
Le lecteur de plaque donne des densités optiques (DO) correspondantes à chaque puit, à extraire dans un tableur pour le traitement. La détermination des concentrations se fait selon les étapes suivantes :
- Soustraire de chaque DO la DO correspondant au 0 (DO du tampon)
- Déterminer l’équation de la gamme (qui généralement est linéaire, avec les concentrations de gamme X et les DO correspondantes en Y) : DO=A*[C] + B
- A partir de cette équation de gamme, déterminer les concentrations en introduisant les valeurs de DO obtenues pour les échantillons. Ramener ces concentrations aux valeurs réelles en fonction de la dilution de l’échantillon opérée.
- Toutes les mesures qui sortent de la gamme doivent être exclues (dans c cas, modifier les dilutions initiales pour pouvoir rentrer dans la gamme)
Mots Clés :
Physiologie, dosage, plasma
Références :
Voller A, Bartlett A, Bidwell DE. Enzyme immunoassays with special reference to ELISA techniques. J Clin Pathol. 1978 Jun;31(6):507-20.
Exemple d’Application en Physiologie de l’exercice
- Monchanin G, Serpero LD, Connes P, Tripette J, Wouassi D, Bezin L, Francina A, Ngongang J, de la Pena M, Massarelli R, Gozal D, Thiriet P, Martin C. Effects of a progressive and maximal exercise on plasma levels of adhesion molecules in athletes with sickle cell trait with or without {alpha}-thalassemia. Journal of Applied Physiology 102(1): 169-173, 2007.
Biographie de l’auteur
 Cyril Martin est MCU-HDR (Physiologie) au Laboratoire Interuniversitaire de Biologie de la Motricité de l’Université de Lyon. Il développe depuis une quinzaine d’années des recherches sur les effets de l’exercice musculaire et de l’activité physique chez les sujets porteurs d’anomalies du globule rouge (trait drépanocytaire, anémie falciforme). Ses travaux sont centrés sur des analyses des mécanismes inflammatoires, hématologiques, hémorhéologiques et du stress oxydant.
Cyril Martin est MCU-HDR (Physiologie) au Laboratoire Interuniversitaire de Biologie de la Motricité de l’Université de Lyon. Il développe depuis une quinzaine d’années des recherches sur les effets de l’exercice musculaire et de l’activité physique chez les sujets porteurs d’anomalies du globule rouge (trait drépanocytaire, anémie falciforme). Ses travaux sont centrés sur des analyses des mécanismes inflammatoires, hématologiques, hémorhéologiques et du stress oxydant.